
INIBIDORES DO PCSK-9: QUAL O IMPACTO NO TRATAMENTO DA HIPERCOLESTEROLEMIA FAMILIAR HETEROZIGÓTICA?
PCSK-9 Inhibitors: What Is Their Impact on the Treatment of Heterozygous Familial Hypercholesterolemia?
Francisca Joelma Rodrigues de Lima1, Amanda Batista Alves2, Roberto José Bittencourt3, Vinícius Oliveira Domingues4, Ana Raquel Nascimento Lawall5, Vítor de Carvalho Neiva Pinheiro6, Fernanda Silveira Tavares7
Endereço correspondente: synynho21@hotmail.com
Publicação: 15/01/2025
DOI: 10.55703/27644006050103
Download PDF – Português (Disponível em breve)
Download PDF – English (Available soon)

RESUMO
Objetivo: realizar uma revisão sistemática da literatura sobre a eficácia dos inibidores da PCSK-9 na hipercolesterolemia familiar heterozigótica (HFH). Metodologia: foram utilizadas fontes das bases de dados PubMed, Medline, LILACS, portal da CAPES e biblioteca do Cochrane no período de janeiro de 2012 a março de 2017, incluindo ensaios clínicos e estudos relacionados com a população diagnosticada com hipercolesterolemia familiar heterozigótica. A análise dos estudos incluiu avaliação da metodologia realizada por cada estudo, delimitação do número de participantes e tempo de realização da pesquisa para que, posteriormente, pudesse ser verificado o desfecho de cada estudo e compará-los para analisar o impacto dos inibidores de PCSK-9. Resultados: foram encontrados 261 artigos, sendo que 6 estudos foram incluídos nesta revisão sistemática. Analisando os seis estudos, pode ser observado que, ao final das pesquisas, os inibidores da PCSK-9 estudados (alirocumab e evolucumab) reduzem significativamente os níveis de LDL-c em pacientes com HFH, com taxas de redução variando entre 28,87% a 67,9%, sendo que o menor valor de redução foi com a utilização de alirocumab 150 mg mensalmente e o maior valor de redução foi com a utilização de evolucumab 140 mg de 2 em 2 semanas. Conclusões: os inibidores da PCSK-9 diminuem os níveis de LDL-c, sendo promissores para o tratamento da hipercolesterolemia familiar heterozigótica nos casos em que as terapias antilipídicas em doses máximas não conseguem obter os resultados desejados.
ABSTRACT
Objective: This study aims to conduct a systematic review regarding the efficacy of PCSK-9 inhibitors in the treatment of heterozygous familial hypercholesterolemia (HFH). Methods: Collected data from PubMed, MedLine, LILACS, CAPES and Cochrane databases included clinical trials and studies that have been published from January, 2012 to March, 2017, involving patients who have been diagnosed with heterozygous familial hypercholesterolemia. Evaluation of the studies involved the analysis of their methods, duration and number of subjects for further comparison between their results in order to analyze the impact of PCSK-9 inhibitors.Results: A total of 261 articles were collected, while 6 of those were included in this review. Analysis of these studies shows that by the end of the researches, PCSK-9 inhibitors (alirocumab and evolocumab) could reduce the levels of LDL-c in patients diagnosed with HFH, with reduction rates ranging from 28,97% to 67,9%. The smallest decrease in LDL-c was found in patients treated with alirocumab 150 mg monthly, while the biggest decrease was achieved by patients treated with evolocumab 140 mg every 2 weeks.Conclusion: PCSK-9 inhibitors can reduce LDL-c levels, and are promising new agents in the treatment of heterozygous familial hypercholesterolemia in patients who cannot achieve the desired LDL-c levels under lipid-lowering therapies at maximum tolerated doses.
INTRODUÇÃO
Segundo a Organização Mundial da Saúde (OMS), as doenças cardiovasculares são ainda a causa mais comum de morte no Brasil e em todo o mundo, sendo a hipercolesterolemia o principal fator de risco modificável.1,2 A presença de doença aterosclerótica em homens e mulheres eleva em mais de 20% o risco de desenvolver o primeiro ou novos eventos cardiovasculares (CV). Estes pacientes são considerados de alto risco para evento coronariano e, levando em consideração que a maioria destes indivíduos são assintomáticos e têm um evento coronariano agudo como primeira manifestação clínica tardia da doença em mais da metade dos casos, tornam-se claras as necessidades de prevenção dos eventos CV por medidas comportamentais ou farmacológicas objetivando a diminuição dos níveis séricos do colesterol, sendo a meta primária voltada para a redução do colesterol tipo LDL-c e a meta secundária para o colesterol não-HDL.2
Apesar de diretrizes recomendarem estatinas como primeira escolha para casos que necessitam de terapia farmacológica, muitos pacientes não obtêm um controle lipídico adequado ou apresentam intolerância ao tratamento com essa classe de medicamentos, o que ocorre mais comumente em casos de hipercolesterolemia familiar (HF).4
A hipercolesterolemia familiar é uma doença autossômica dominante e está associada, na maioria das vezes, a mutações no receptor de captação hepática da lipoproteína de baixa densidade (LDLR), que remove as partículas de LDL da circulação sanguínea.3,4,5 Uma forma menos frequente de HF é a mutação do domínio de ligação da apolipoprotéina (apo) B100, um dos componentes do LDL. A identificação de um terceiro gene localizado no cromossomo 1p32.3 envolvido na patogênese da HF por Goldstein e Brown garantiu a esses pesquisadores o Prêmio Nobel em 1985, quarenta anos após os mesmos descobrirem o LDLR. Esse gene codifica a pró-proteína convertase subtilisina/Kexin tipo 9 (PCSK-9), originalmente chamada de convertase 1 regulada por apoptose neuronal (NARC-1).6
A expressão do gene PCSK-9 é modulada especialmente pela concentração de colesterol dentro da célula, e a PCSK-9 é primariamente sintetizada no fígado e no intestino delgado.5 Sua função é regular as concentrações plasmáticas de colesterol pelo mecanismo de inibição do LDLR, principalmente no fígado. Uma vez ativado, reduz as concentrações de LDLR e aumenta as concentrações de LDL-c no sangue.4,5 Alguns dados sugerem ainda que a PCSK-9 também possa influenciar no metabolismo de triglicerídeos e no acúmulo destes no tecido adiposo visceral.5 Aqueles que tiverem esse gene mutado apresentam níveis mais baixos de LDL-C e menor risco de eventos CV. De forma análoga, foram estudadas terapias anti-ateroscleróticas com oligonucleotídeos antisense que se ligam ao RNAm e inibem a síntese proteica, ou com anticorpos monoclonais (mAbs) contra PCSK-9 sendo essa abordagem com pesquisas mais avançadas e com ensaios clínicos publicados em fases 2 e 3 em seres humanos.4,5
Até o momento, encontram-se disponíveis para uso em seres humanos três anticorpos monoclonais: dois mAbs totalmente humanos, SAR236553/REGN727 (alirocumab) e AMG145 (evolocumab), e um mAb humanizado RN316/PF04950615 (bococizumab).5 O objetivo desta revisão é comparar os resultados obtidos pelos mais recentes estudos realizados em pacientes com hipercolesterolemia familiar heterozigótica (HFHe) em uso de inibidores da PCSK-9.
METODOLOGIA
Este estudo se trata de uma revisão sistemática, que buscou fontes nas bases de dados PubMed, Medline, LILACS, portal da CAPES e biblioteca do Cochrane no período de janeiro de 2012 a março de 2017, com a utilização das seguintes palavras-chave em inglês e em português: PCSK-9 inhibitor (inibidor da PCSK-9), Proprotein convertase subtilisin/Kexin 9 inhibitor (inibidor da pró-proteína convertase subtilisina/Kexin tipo 9), REGN727/SAR236553, alirocumab, AMG 145, evolucumab, familial hypercholesterolemia (hipercolesterolemia familiar) e heterozygous familial hypercholesterolemia (hipercolesterolemia familiar heterozigótica). Buscas manuais foram feitas nas referências bibliográficas dos artigos encontrados.
Para a inclusão dos artigos, foram empregados os seguintes critérios: estudos intervencionistas, com acompanhamento longitudinal, incluindo, portanto, ensaios clínicos, estudos relacionados com a população diagnosticada com hipercolesterolemia familiar heterozigótica pelos critérios genotípicos ou pelos de Dutch Lipid Clinic Network (Dutch MEDPED) ou pelos do US Make Early Diagnosis Prevent Early Death Program (USA MEDPED) ou pelos do Simon Broome Register Group ou pelos da OMS.
Foram utilizados como critérios de exclusão revisões de literatura, revisões sistemáticas, estudos observacionais como coortes, casos controle, série temporal, estudos ecológicos e inquéritos, estudos com populações compostas por pessoas com hipercolesterolemia que não preenchem pelo menos um dos seguintes critérios previamente citados (genotípicos ou Dutch ou USA MEDPED ou Broome ou OMS) e populações compostas por hipercolesterolemia familiar homozigótica.
A análise dos estudos encontrados foi feita de forma descritiva e incluiu avaliação da metodologia realizada por cada estudo, delimitação do número de participantes e tempo de realização da pesquisa para que, posteriormente, pudesse ser verificado o desfecho de cada estudo e compará-los para analisar o impacto dos inibidores de PCSK-9, utilizando o programa REVMAN 5.3 para a confecção das tabelas e gráficos.
RESULTADOS
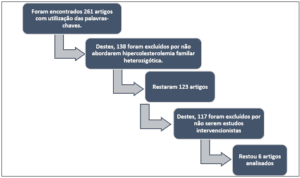
Após analisar todas as bases de dados citadas, foram encontrados 261 artigos, sendo que 138 foram excluídos por não estarem relacionados com hipercolesterolemia familiar heterozigótica. Dos 123 artigos que restaram, 117 foram excluídos por não
serem ensaios clínicos. Ao final, 6 estudos foram incluídos nesta revisão sistemática. A figura 1 faz uma síntese do processo de seleção dos artigos.
Figura 1 – Processo de seleção dos artigos
Metodologia dos estudos
O estudo de STEIN et al foi um ensaio multicêntrico de fase 2 envolvendo 77 pacientes com hipercolesterolemia familiar heterozigótica (HFH) e níveis de LDL-C ≥2,6 mmol/L (100mg/dL) em dieta e dose de estatinas estáveis, com ou sem ezetimibe. Os pacientes foram randomizados, na proporção de 1:1:1:1:1, para receberem alirocumab 150 mg, 200 mg ou 300 mg mensalmente, alirocumab 150 mg a cada duas semanas, ou placebo a cada duas semanas. A randomização foi estratificada pelo uso concomitante de ezetimibe no início do estudo. O desfecho primário foi a redução percentual média em LDL-c entre o início do tratamento e a semana 12.
Já os estudos ODYSSEY HIGH FH (n=107), ODYSSEY FH I (n=486) e ODYSSEY FH II (n=249) se caracterizaram como ensaios multicêntricos e multinacionais de fase 3, que analisaram pacientes com HFH mal controlada, mesmo com a utilização de dose máxima de estatinas por um período ≥4 semanas antes do início do estudo, com ou sem outra terapia antilipídica associada. Os pacientes foram randomizados na proporção de 2:1 para receber alirocumab 75 mg ou placebo a cada 2 semanas durante 78 semanas. Caso os níveis de LDL-c dos pacientes que receberam alirocumab se mantivessem ≥70 mg/dL na semana 8, a dose bissemanal seria aumentada para 150 mg a partir da semana 12. O desfecho analisado em todos os três estudos foi a mudança percentual nos níveis de LDL-C entre o início do tratamento e a semana 24.
O estudo RUTHERFORD foi um ensaio multicêntrico de fase 2 no qual 167 pacientes com HFH e concentrações de LDL-c ≥100mg/dL, mesmo com uso de estatinas ± ezetimibe foram randomizados na proporção de 1:1:1 para tratamento com evolocumab 350 mg, evolocumab 420 mg ou placebo, administrados via subcutânea a cada 4 semanas. Seu desfecho primário foi a mudança percentual nos níveis de LDL-c entre o início do estudo e a semana 12. Posteriormente, o estudo multicêntrico de fase 3 RUTHERFORD 2 (n=331) analisou pacientes diagnosticados com HFH, com LDL-c ≥100mg/dL, que já realizavam tratamento antilipídico por pelo menos 4 semanas. Estes foram randomizados em uma proporção de 2:2:1:1 para receber evolocumab 140 mg subcutâneo a cada 2 semanas (n=111), evolocumab 420 mg mensalmente (n=110) ou placebo a cada duas semanas (n=55) ou a cada mês (n=55), durante 12 semanas. Os desfechos primários foram a mudança percentual do LDL-c na semana 10 e a redução média dos níveis de LDL-C entre as semanas 10 e 12. A tabela 1 mostra as características das populações estudadas em cada estudo analisado, antes do início da terapia com inibidores da PCSK-9.
Tabela 1 – Características sociodemográficas e comorbidades dos participantes dos estudos.
| ODYSSEY FH I | ODYSSEY FH II | ODYSSEY HIGH | RUTHERFORD | RUTHERFORD II | STEIN | |
| Número de participantes | 486 | 249 | 107 | 168 | 331 | 77 |
| Idade (anos) | 51,9 | 53,2 | 50,95 | 49,57 | 50,6 | 53,4 |
| Sexo Masculino
n (%) |
274
(56%) |
131
(52%) |
57
(53%) |
89
(52%) |
192
(58%) |
47
(61%) |
| Sexo Feminino
n (%) |
212 (44%) | 118
(48%) |
50
(47%) |
79
(48%) |
139
(42%) |
30
(39%) |
| IMC | 29,5 | 28,15 | 28,5 | —– | —– | 29,1 |
| Brancos
n (%) |
444
(91%) |
244
(97%) |
94
(87%) |
148
(88%) |
—– | 73
(94%) |
| Outras raças
n (%) |
42
(9%) |
5
(3%) |
13
(13%) |
20
(12%) |
—– | 4
(6%) |
| Doença coronariana
n (%) |
225
(46%) |
89
(35%) |
53
(49%) |
35
(20%) |
113
(34%) |
32
(41%) |
| Risco de doenças coronarianas
n (%) |
79
(16%) |
19
(7%) |
18
(16%) |
—- | —– | —– |
| Fumantes
n (%) |
69
(14%) |
49
(19%) |
21
(19%) |
28
(16%) |
—– | —– |
| Hipertensos
n (%) |
210
(43%) |
81
(32%) |
71
(66%) |
—– | —– | —– |
| Diabetes tipo 2
n (%) |
57
(11%) |
10
(4%) |
15
(14%) |
—– | —– | 3
(3%) |
| Uso de estatina
n (%) |
486
(100%) |
249
(100%) |
107
(100%) |
168
(100%) |
331
(100%) |
77
(100%) |
| Dose alta de estatina
n (%) a |
406
(83%) |
220
(88%) |
78
(72%) |
150
(89%) |
—– | 59 (77%) |
| Uso de ezetimibe n (%) | 278
(57%) |
165
(66%) |
26
(24%) |
108
(64%) |
—– | 55 (71%) |
Os espaços em branco são características não abordadas ou características não quantificadas nos estudos. Atorvastatina 40–80 mg, rosuvastatina 20–40 mg, ou sinvastatina 80 mg diariamente.
Resultados dos estudos
No estudo de STEIN et al, a redução média de LDL-c encontrada na semana 12 foi de 28,9% nos pacientes que utilizaram alirocumab 150 mg mensal, 31,54% nos que usaram 200 mg mensal, 42,53% no grupo de 300 mg mensal, 67,9% no grupo de 150 mg bissemanal, e 10,65% nos pacientes que utilizaram placebo. Já no estudo ODYSSEY HIGH FH, no qual a concentração média de LDL-c era de 196,3 mg/dL nos pacientes que usaram alirocumab e 201 mg/dL no grupo que usou placebo, a redução média de LDL-c até a semana 24 foi de 45,7% no grupo do alirocumab, sendo que estes níveis reduzidos foram mantidos até a semana 78, e de 6,6% no grupo do placebo, caracterizando uma diferença de 39,1% entre os dois grupos. No estudo FH I, os pacientes que receberam alirocumab tiveram uma redução média de 144,7mg/dL no início para 71,3 mg/dL, representando uma redução de 57,9% em relação ao placebo, enquanto em FH II, os pacientes tratados com alirocumab tiveram uma redução média de 134,6 mg/dL para 67,7mg/dL, representando uma redução de 51,4% em relação ao placebo. Níveis de LDL <1,8 mmol/L foram alcançados na semana 24 por 59,8% e 68,2% dos pacientes tratados com alirocumab em FH I e II, respectivamente.
No estudo RUTHERFORD, a concentração média de LDL-c inicial era de 156 mg/dL. Na semana 12, a redução de LDL-c foi de 43% e de 55% com evolocumab 350 mg e 420 mg, respectivamente, sendo que o grupo de pacientes que usaram placebo demonstrou um aumento de 1%. Já em RUTHERFORD 2, o evolocumab levou a uma redução de 59,2% na dose bissemanal e 61,3% na dose mensal após a semana 12, em relação ao placebo. A redução média entre as semanas 10 e 12 foi de 60,2% no tratamento bissemanal e de 65,6% no tratamento com dose mensal. Os dados referentes às amostras, tratamentos, duração e mudança nas concentrações médias de LDL-C de cada estudo analisado podem ser observados na tabela 2.
Tabela 2 – Características dos grupos analisados em cada estudo e resultados de seus desfechos primários.
| Estudo | Stein | ODYSSEY HIGH FG | ODYSSEY FH I | ODYSSEY FH II | RUTHERFORD | RUTHERFORD 2 |
| Amostra total | 77 | 107 | 486 | 249 | 167 | 331 |
| Tratamento | Proporção 1:1:1:1:1
ALC 150 mg/mês ALC 200 mg/mês ALC 300 mg/mês ALC 150 mg/2 sem PLA bissemanal |
Proporção 2:1
ALC 75 mg/2 sem (ou 150 mg a partir da semana 12) PLA/2sem |
Proporção 1:1:1
EVC 350 mg/mês EVC 420 mg/mês PLA mensal |
Proporção 2:2:1:1
EVC 140 mg/ 2 sem EVC 420 mg/mês PLA/2sem PLA mensal |
||
| Duração/ desfecho primário | 12 semanas | 78 semanas | 12 semanas | |||
| LDL-c médio inicial (DP) em mg/dL | 166,9 (50,2) ALC 150 mg/mês
170,2 (57,0) ALC 200 mg 139,8 (24,7) ALC 300 mg 147,4 (32,6) ALC 150 mg/2 sem 151,0 (34,0) PLA |
196,3 (57,9) ALC
201,0 (43,4) PLA |
144,7 (2,9) ALC
144,4 (3,7) PLA |
134,6 (3,2) ALC
134,0 (4,6) PLA |
154,7 (46,4) EVC 350 mg
146,9 (38,7) EVC 420 mg 158,5 (46,4) PLA |
162,4 (50,3) EVC 140 mg
154,7 (42,5) EVC 420 mg 150,8 (34,8) PLA/2 sem 150,8 (42,5) PLA mensal |
| Mudança média de LDL-c | Semana 12
-28,87 (5,08)% ALC 150 mg/mês -31,54 (4,91)% ALC 200 mg -42,53 (5,09)% ALC 300 mg -67,9 (4,85)% ALC 150 mg/2 sem -10,65 (5,04)% PLA |
Semana 24
-45,7 (3,5)% ALC -6,6% (4,9)% PLA |
Semana 24
-48,8 (1,6)% ALC -9,1 (2,2)% PLA |
Semana 24
-48,7 (1,9)% ALC -2,8 (2,8)% PLA |
Semana 12
-42,7% (2,9) EVC 350 mg -55,2% (2,9) EVC 420 mg 1,1 (2,9)% PLA |
Semana 12
-61,3 (3,2)% EVC 140 mg -55,7 (4,4)% EVC 420 mg -2 (4,9)% PLA/2 sem -5,5 (6,4)% PLA mensal |
| DP: desvio-padrão; ALC: alirocumab; EVC: evolocumab; PLA: placebo; 2 sem: bissemanal; | ||||||
Tabela 3 – Eficácia dos inibidores da PCSK-9 em relação ao grupo placebo
| Eficácia dos inibidores da PCSK-9 | |||||||||
| Experimental | Placebo | Diferença Média | |||||||
| Estudo ou subgrupo | Média | DP | Total | Média | DP | Total | Peso | IV, Fixo, 95% IC | |
| 1.Alirocumab 75 mg 2/2 semanas | |||||||||
| ODYSSEY FH I | -48,8 | 1,6 | 323 | 9,1 | 2,2 | 163 | 32,3% | -57,90 [-58,28, -57,52] | |
| ODYSSEY FH II | -48,7 | 1,9 | 167 | 2,8 | 2,8 | 82 | 10,4% | -51,50 [-52,17, -50,83] | |
| Subtotal (95% CI) | 490 | 245 | 42,7% | -56,35 [-56,68, -56,01] | |||||
| Heterogenicidade: Chi² = 264.52, df = 1 (P <0.00001); I² = 100% | |||||||||
| Teste de efeito global: Z = 333.88 (P <0.00001) | |||||||||
| 2.Alirocumab 150 mg 2/2 semanas | |||||||||
| ODYSSEY FH I | -48,8 | 1,6 | 323 | 9,1 | 2,2 | 163 | 32,3% | -57,90 [-58,28, -57,52] | |
| ODYSSEY FH II | -48,7 | 1,9 | 167 | 2,8 | 2,8 | 82 | 10,4% | -51,50 [-52,17, -50,83] | |
| ODYSSEY HIGH | -45,7 | 3,5 | 72 | -6,6 | 4,9 | 35 | 1,4% | -39,10 [-40,91, -37,29] | |
| STEIN | -67,9 | 4,85 | 16 | -10,65 | 5,04 | 15 | 0,4% | -57,25 [-60,74, -53,76] | |
| Subtotal (95% CI) | 578 | 295 | 44,5% | -55,80 [-56,13, -55,48] | |||||
| Heterogenicidade: Chi² = 601.37, df = 3 (P <0.00001); I² = 100% | |||||||||
| Teste de efeito global: Z = 337.58 (P <0.00001) | |||||||||
| 3.Alirocumab 150 mg mensal | |||||||||
| STEIN | -28,87 | 5,08 | 15 | -10,65 | 5,04 | 15 | 0,4% | -18,22 [-21,84, -14,60] | |
| Subtotal (95% CI) | 15 | 15 | 0,4% | -18,22 [-21,84, -14,60] | |||||
| Heterogenicidade: não aplicável | |||||||||
| Teste de efeito global: Z = 9.86 (P <0.00001) | |||||||||
| 4.Alirocumab 200 mg mensal | |||||||||
| STEIN | -31.54 | 4,91 | 16 | -10,65 | 5,04 | 15 | 0,4% | -20,89 [-24,40, -17,38] | |
| Subtotal (95% CI) | 16 | 15 | 0,4% | -20,89 [-24,40, -17,38] | |||||
| Heterogenicidade: não aplicável | |||||||||
| Teste de efeito global: Z = 11.68 (P <0.00001) | |||||||||
| 5.Alirocumab 300 mg mensal | |||||||||
| STEIN | -42,53 | 5,09 | 15 | -10,65 | 5,04 | 15 | 0,4% | -31,88 [-35,50, -28,26] | |
| Subtotal (95% CI) | 15 | 0,4% | -31,88 [-35,50, -28,26] | ||||||
| Heterogenicidade: não aplicável | |||||||||
| Teste de efeito global: Z = 17.24 (P <0.00001) | |||||||||
| 6.Evolucumab 140 mg 2/2 semanas | |||||||||
| RUTHERFORD | -61,3 | 3,25 | 111 | -2 | 4.9 | 55 | 2,3% | -59,30 [-60,73, -57,87] | |
| Subtotal (95% CI) | 111 | 55 | 2,3% | -59,30 [-60,73, -57,87] | |||||
| Heterogenicidade: não aplicável | |||||||||
| Teste de efeito global: Z = 81.32 (P <0.00001) | |||||||||
| 7.Evolucumab 350 mg mensal | |||||||||
| RUTHERFORD | -42,7 | 2,9 | 56 | 1.1 | 2.9 | 56 | 4,0% | -43,80 [-44,87, -42,73] | |
| Subtotal (95% CI) | 56 | 56 | 4,0% | -43,80 [-44,87, -42,73] | |||||
| Heterogenicidade: não aplicável | |||||||||
| Teste de efeito global: Z = 79.92 (P <0.00001) | |||||||||
| 8.Evolucumab 420 mg mensal | |||||||||
| RUTHERFORD | -55,2 | 2,9 | 56 | 1.1 | 2.9 | 56 | 4,0% | -56,30 [-57,37, -55,23] | |
| RUTHERFORD 2 | -55,2 | 4,45 | 110 | 5,5 | 6,45 | 55 | 1,3% | -61,20 [-63,10, -59,30] | |
| Subtotal (95% CI) | 166 | 111 | 5,3% | -57,49 [-58,42, -56,56] | |||||
| Heterogenicidade: Chi² = 19.41 df = 1 (P <0.00001); I² = 95% | |||||||||
| Teste de efeito global: Z = 120.55 (P <0.00001) | |||||||||
| TOTAL (95% CI) | 1447 | 807 | 100,00% | -55,37 [-55,58, -55,15] | |||||
| Heterogenicidade: Chi² = 2357.12 df = 12 (P <0.00001); I² = 99% | |||||||||
| Teste de efeito global: Z = 502.02 (P <0.00001) | |||||||||
| Teste para diferença dos subgrupos Chi² = 1471.81 df = 7 (P <0.00001); I² = 99,5% | |||||||||
Considera-se a redução percentual da concentração de LDL entre o início do tratamento e o desfecho primário. A tabela acompanha o gráfico forest plot.
Eventos adversos
Nos estudos realizados com alirocumab (STEIN, ODYSSEY HIGH FH, FHI e FH II), o efeito adverso mais comum foi a reação no local de injeção. Em ODYSSEY HIGH FH, reações no local da injeção foram mais frequentes no grupo do alirocumab (8,3%) em relação ao placebo (5,7%). A taxa de reações no local de injeção nos pacientes tratados com alirocumab foi de 12,4% em FHI e 11,4% em FHII (contra 11,0% e 7,4% nos usuários de placebo).
Em ODYSSEY HIGH FH, os efeitos adversos foram comparáveis nos dois grupos, tendo sido, em sua maioria, leves em severidade, não resultando em descontinuação do medicamento. Em FH I e II, os efeitos adversos resultaram, respectivamente, em descontinuação do tratamento em 3,4% e 3,6% dos pacientes tratados com alirocumab. No estudo de STEIN, um paciente do grupo de alirocumab 300 mg teve o tratamento interrompido após a reação. Além disso, houve o relato de efeito adverso severo em um paciente no grupo placebo.
Em RUTHERFORD 2, os efeitos adversos mais frequentes nos pacientes tratados com evolocumab em relação aos que receberam placebo foram nasofaringite (9% contra 5% no grupo placebo) e mialgia (5% contra 1% no grupo placebo). Dois eventos adversos mais severos foram observados em RUTHERFORD, no qual um paciente apresentou fibrilação atrial e outro paciente apresentou apendicite com infecção de ferida operatória. Porém, estes eventos não foram considerados como sendo relacionados ao tratamento.
Conclusões dos estudos
Em suas conclusões, os estudos realizados com alirocumab afirmaram que este inibidor da PCSK-9 é bem tolerado, tendo alcançado reduções significativas de LDL-c em pacientes com HFH e LDL-c elevado tratado com altas doses de estatinas, com ou sem ezetimibe. Os estudos ODYSSEY FH I e II ressaltam que a redução da concentração de LDL-c foi mantida após 52 semanas. Quanto aos estudos da série RUTHERFORD, estes afirmaram em suas conclusões que o evolocumab administrado trouxe reduções rápidas e substanciais aos níveis de LDL-c nos pacientes com HFH mesmo com uso intensivo de estatinas, com ou sem ezetimibe, com efeitos adversos mínimos e boa tolerabilidade (Tabela 3).
DISCUSSÃO
As estatinas, juntamente ou não com o ezetimibe, têm sido o pilar do tratamento de dislipidemia por décadas, sendo medicamentos de primeira escolha para o tratamento desta condição. Porém, ainda há um número desproporcionalmente elevado de pacientes (cerca de 20%) que não possuem os níveis lipídicos controlados, como no caso dos pacientes com hipercolesterolemia familiar, tornando-os pessoas com alto risco de desenvolvimento de doença aterosclerótica.9
A descoberta da PCSK-9 há quinze anos trouxe uma nova perspectiva de tratamento para a dislipidemia. Isso proporcionou o surgimento de inibidores da PCSK-9, como o alirocumab, o evolocumab e o mais novo dos inibidores, o bococizumab, que se mostram promissores na redução do LDL-c.
Ao se comparar os estudos em relação às características sociodemográficas e comorbidades dos participantes, verifica-se um alto número de indivíduos analisados, porém, com características semelhantes. A idade dos participantes variava entre 49,57 a 53,4, o número de participantes do sexo masculino é discretamente mais elevado que o feminino, e o número de participantes com doença coronariana também se assemelha, assim como o IMC dos pacientes, que se encontram na classificação sobrepeso em todos os estudos que abordaram este dado, o que contribui, juntamente à concentração de LDL-c, com o aumento dos riscos cardiovasculares.
Outro aspecto considerado é a quantidade de pessoas que utilizavam estatinas. Em todos os estudos, 100% dos participantes usavam o medicamento, sendo que a maioria dos participantes (mais de 70%) utilizavam de sua dose alta. Com relação ao uso do ezetimibe, a maioria dos participantes dos estudos, com exceção do ODYSSEY HIGH FH, que não teve a maioria dos estudados utilizando ezetimibe (24%), e o estudo RUTHERFORD 2, que não abordou este dado de forma numérica, o utilizavam em conjunto às estatinas. Estes fatos, que foram usados como critérios de inclusão nas pesquisas, corroboram para a necessidade de se desenvolver novos tratamentos para hipercolesterolemia familiar heterozigótica, já que os medicamentos convencionais, mesmo em doses otimizadas, não estão conseguindo diminuir os valores de perfil lipídico para níveis adequados.
Ficou evidente nos estudos analisados a predominância da população caucasiana, fato relacionado com a seleção dos locais nos quais as pesquisas foram aplicadas, que eram países europeus e países africanos com predomínio da população branca. Issso reforça a necessidade de estudos com maior contingente de pacientes de outras etnias, como as de predomínio genético afrodescendente, pois estas populações possuem níveis pressóricos mais altos e de difícil controle, estando mais propensas a eventos cardiovasculares desfavoráveis quando estão com níveis lipídicos aumentados.7,14,15
Analisando os seis estudos em relação aos seus resultados, pode ser observado que, ao final das pesquisas, os inibidores da PCSK-9 estudados (alirocumab e evolucumab) reduzem significativamente os níveis de LDL-c em pacientes com HFH, com taxas de redução variando entre 28,87% a 67,9%, sendo que o menor valor de redução foi com a utilização de alirocumab 150 mg mensalmente e o maior valor de redução foi com a utilização de evolucumab 140 mg de 2 em 2 semanas. Comparando os dados no gráfico forest plot, foi possível verificar que todos os estudos foram favoráveis para o grupo experimental com o uso dos inibidores de PCSK-9, independentemente do tipo de medicamento utilizado.
Além disso, foi observado que os inibidores da PCSK-9 apresentam boa tolerabilidade pelos pacientes. Os artigos demonstram que os eventos adversos apresentados nos grupos em uso de inibidores da PCSK-9 são similares aos dos grupo que utilizaram placebo, e não foram relatados efeitos colaterais graves ou mortes, sendo os principais efeitos adversos ligado à reação no local de aplicação do anticorpo monoclonal 7.
Apesar de os estudos analisados não terem levado em consideração a aplicabilidade em larga escala dos inibidores de PCSK-9 em relação ao custo dos tratamentos, existem dados em outros estudos que levantam esta questão. Uma revisão feita por SMITH et al mostrou que o preço médio estimado do tratamento com inibidores da PCSK-9 varia entre aproximadamente US$7000,00 a US$14600,00 anualmente, enquanto o tratamento com estatinas apresenta valores de aproximadamente US$144,00 a US$6000,00 anuais. Assim, a terapia com inibidores da PCSK-9 pode ficar restrita a um número muito reduzido de pacientes, e sua aplicação pode ser ainda mais difícil nos países em desenvolvimento. Até o momento, o Food and Drug Administration (FDA) só indica esse anticorpo para pessoas portadoras de hipercolesterolemia familiar não controlada em uso de estatinas em doses máximas e dieta alimentar, e para indivíduos portadores de alto risco para eventos cardiovasculares devido a aterosclerose 9.
CONCLUSÃO
Considerando a importância da diminuição dos níveis de LDL-c na prevenção de doenças cardiovasculares e observando os resultados favoráveis ao uso dos inibidores da PCSK-9 nos estudos analisados, é possível inferir que o impacto destes medicamentos na modificação de fatores de risco em pacientes com hipercolesterolemia familiar heterozigótica os coloca como um promissor adjuvante ao tratamento desta doença nos casos em que as terapias antilipídicas em doses máximas não conseguem obter os resultados desejados. Porém, alguns desafios para que seu uso seja feito em larga escala, como a resposta imune dos anticorpos de PCSK-9 após um tratamento prolongado, as potenciais interações com outras enzimas e proteases, sua real viabilidade no quesito custo-benefício e a sua ação em populações em diferentes grupos étnicos, ainda persistem, mas novos estudos podem trazer avanços quanto a estas questões. Além disso, os resultados dos ensaios de fase 3 com o bococizumab podem trazer novas perspectivas quanto ao uso dos inibidores da PCSK-9 no tratamento da hipercolesterolemia familiar.
REFERÊNCIAS
- World Health Organization. Familial hypercholesterolemia (FH). Report of a WHO consultation. Paris: WHO: Human Genetic Programme; 1997 October. (Report No.WHO/HGN/FH/CONS/98.7)
- Pereira AC, Gagliardi ACM, Lottenberg AM, Chacra APM, Faludi AA, Sposito AC et al . I Diretriz Brasileira de Hipercolesterolemia Familiar (HF). Bras. Cardiol. [Internet]. 2012 Aug [cited 2017 Apr 04] ; 99( 2 Suppl 2 ): 1-28. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0066-782X2012001700001&lng=en. http://dx.doi.org/10.5935/abc.20120202.
- Verbeek R, Stoekenbroek RM, Hovingh GK. PCSK9 inhibitors: Novel therapeutic agents for the treatment of hypercholesterolemia. European Journal of Pharmacology. 2015;763(Part A):38 – 47.
- Stoekenbroek RM, Kastelein JJ. PCSK9 inhibition: the way forward in the treatment of dyslipidemia. BMC Medicine. 2015;13(258):1 – 6
- Farnier M. PCSK9: From discovery to therapeutic applications. Archives of Cardiovascular Disease. 2014;107(1):58 – 66
- Corral Pablo. De Volta ao Basico: PCSK9 como um Novo Alvo para o Receptor LDL. Arq. Cardiol. [Internet]. 2014 Jan [cited 2017 Mar 13] ; 102( 1 ): e5. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0066-782X2014000100019&lng=en. http://dx.doi.org/10.5935/abc.20130248.
- Ginsberg HN, Rader DJ, Raal FJ, Guyton JR, Baccara-Dinets MT, Lorenzato C, et al. Efficacy and Safety of Alirocumab in Patients with Heterozygous Familial Hypercholesterolemia and LDL-C of 160 mg/dl or Higher. Cardiovasc Drugs Ther 30:473–483, 2016.
- Kastelein JJP, Robinson JG, Farnier M, Krempf M, Langslet G, Lorenzato C, et al. Efficacy and Safety of Alirocumab in Patients with Heterozygous Familial Hypercholesterolemia not Adequately Controlled with Current Lipid-Lowering Therapy: Design and Rationale of the ODYSSEY FH Studies. Cardiovasc Drugs Ther 28:281–289, 2014.
- Smith LL, Mosley II JF, Yates J, Caswell L. The New Face of Hyperlipidemia Management: Proprotein Convertase Subtilisin/Kexin Inhibitors (PCSK-9) and Their Emergent Role As An Alternative To Statin Therapy. J Pharm Pharm Sci. 19 (1) 137-146, 2016.
- Galema-Boers JMH, Lenzen MJ, Sijbrands EJ, Roeters van LENNEP JE. Proprotein convertase subtilisin / Kexin 9 inhibition in patients with Familial Hypercholesterolemia: initial clinical experience. JACL, 2017.
- Stein EA, Gipe D, Bergeron J, Gaudet D, Weiss R, Dufour R, et al. Effect of a monoclonal antibody to PCSK9, REGN727/ SAR236553, to reduce low-density lipoprotein cholesterol in patients with heterozygous familial hypercholesterolaemia on stable statin dose with or without ezetimibe therapy: a phase 2 randomised controlled trial. The Lancet, 380, 2012.
- Raal F, Scott R, Somaratne R, Bridges I, Li Gang, Wasserman SM, et al. The Reduction of LDL-C with PCSK9 Inhibition in Heterozygous Familial Hypercholesterolemia Disorder (RUTHERFORD) Randomized Trial. http://circ.ahajournals.org, 2012.
- Raal FJ, Stein EA, Dufour R, Turner T, Civeira F, Burgess L, et al. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. The Lancet, 385, 2015.
- Xavier HT, Izar MC, Faria NJR, Assad MH, Rocha VZ, Sposito AC, et al. V Diretriz Brasileira de Dislipidemia e Prevenção da Aterosclerose. www.arquivosonline.com.br, 101(4), 2013.
- Malachias MVB, Souza WKSB, Plavinick FL, Rodrigues CIS, Brandão AA, Neves MFT, et al. 7ª Diretriz Brasileira de Hipertensão. www.arquivosonline.com.br, 107(3), 2016.
